Отечно-асцитический синдром — это состояние, характеризующееся накоплением жидкости в клетчатке и полостях тела, в основном в брюшной полости (асцит). Обычно он возникает в результате заболеваний сердечно-сосудистой системы, печени, почек или проблем с лимфатической системой, что приводит к нарушению водно-электролитного баланса.
При наличии данного синдрома наблюдаются отеки, как правило, на нижних конечностях, а также вздутие живота из-за скопления жидкости. Лечение обычно направлено на устранение основной причины, а также на уменьшение отечности и асцита с помощью диетотерапии, медикаментов или, в некоторых случаях, хирургического вмешательства.
- Отечно-асцитический синдром – это состояние, характеризующееся накоплением жидкости в тканях (отечность) и в полостях органов (асцит).
- Часто возникает при заболеваниях сердца, печени и почек, а также при некоторых онкологических заболеваниях.
- Симптомы включают отеки конечностей, увеличение объема живота, одышку и дискомфорт.
- Диагностика основывается на клиническом осмотре, анализах крови и ультразвуковом исследовании.
- Лечение направлено на устранение причины синдрома и может включать диетические изменения, медикаментозную терапию и, в некоторых случаях, оперативное вмешательство.
Асцит — это накопление жидкости в области живота. Чаще всего этот синдром наблюдается при циррозе печени. Термин «асцит» происходит от греческого слова ascos, что переводится как «мешок» или «сумка». Врачи знакомы с этим состоянием с эпохи Гиппократа. На протяжении долгого времени единственным методом лечения асцита оставался парацентез.
Асцит может проявляться как внезапно, так и постепенно, развиваясь на протяжении нескольких недель или месяцев. Быстрое появление асцита может сигнализировать о печеночно-клеточной недостаточности, возникающей на фоне шока, интоксикации или геморрагического синдрома и других состояний.
Постепенное развитие асцита обусловлено наличием длительно текущего, далеко зашедшего патологического процесса, часто При отсутствии определенного причинного фактора. При асците наблюдается увеличение в объеме живота, появление метеоризма, одышки. При большом количестве асцитической жидкости (15-20 л) появляются дополнительные симптомы: пупочные и паховые грыжи, геморроидальных вен, смещение диафрагмы вверх, верхушечного толчка — вверх и влево, повышение давления в яремной вене, набухание шейных вен. У таких больных могут определяться диафрагмальная грыжа, желудочно-пищеводный рефлюкс.
Примерно у 6-7% пациентов с циррозом печени наблюдается правосторонний гидроторакс.
Разберем патогенез (что происходит?) в рамках отечно-асцитического синдрома:
Патогенез асцита у больных циррозом печени является многофакторным. Портальная гипертензия и связанный с ней застой в системе воротной вены являются пусковыми факторами развития асцита. Кроме того, развитию асцита способствует каскад нейрогормональных, гемодинамических и вводно-электролитных сдвигов. В настоящее время патогенез асцита рассматривается как индивидуальное сочетание многочисленных патогенетических факторов прогрессирования основного патологического процесса, которые условно разделены на местные (регионарные) и общие (системные).
Отечно-асцитический синдром представляет собой комплекс клинических проявлений, связанных с задержкой жидкости в организме. Этот синдром обычно сопровождается отеками, которые могут возникать как на конечностях, так и в других частях тела, а также асцитом — скоплением жидкости в брюшной полости. Важно понимать, что отечная реакция может возникать по различным причинам, включая сердечно-сосудистые заболевания, заболевания печени, почек, а также воспалительные и травматические процессы.
Выявление отечно-асцитического синдрома требует комплексного подхода, который включает тщательную диагностику и анализ сопутствующих симптомов. Для определения причины возникновения данного состояния важно учитывать такие факторы, как история болезни пациента, его физическое состояние, а также результаты лабораторных и инструментальных исследований. Часто основное внимание уделяется функции печени и почек, поскольку их недостаточная деятельность может привести к накоплению жидкости и развитию данного синдрома.
Лечение отечно-асцитического синдрома зависит от его первопричины. В большинстве случаев необходима коррекция диеты, ограничение потребления соли и жидкости, а также применение диуретиков для уменьшения отеков и асцита. В некоторых случаях может потребоваться проведение терапии основного заболевания, которая позволит устранить причину возникновения синдрома. Поэтому важно, чтобы лечение проводилось под контролем опытного специалиста, что обеспечит наилучший прогноз для пациента.
Местные регионарные факторы включают повышение сопротивления кровотоку в печени, вызванное сочетанием органических и функциональных нарушений. В зависимости от уровня поражения при хронической заболевания печени, можно выделить преси-нусоидальный, синусоидальный и постсинусоидальный уровень блока. Изменения могут быть как необратимыми (органическими), так и потенциально обратимыми (функциональными).
Внутрипеченочный блок оттока приводит к увеличению образования лимфы. При этом лимфа может вытекать через лимфатические сосуды глиссоновой капсулы прямо в брюшную полость или поступать в грудной лимфатический проток через область ворот печени. В результате лимфатического застоя происходит вытекание жидкости в брюшную полость.
Ключевым моментом в патогенезе асцита является накопление в циркулирующей крови нерасщепленных эндогенов вазодилататоров (глюкагон и другие), которые способствуют расширению мелких артерий и открытию артериовенозных шунтов в тканях. Это приводит к уменьшению кровенаполнения артерий, увеличению сердечного выброса, гиперволемии и ухудшению портального кровотока, что приводит к портальной гипертензии. Также стоит отметить, что накопление асцитической жидкости снижает эффективный кровоток, поскольку значительная часть объема плазмы оказывается в сосудах брюшной полости. Действие вазодилататоров усиливается из-за уменьшения выработки оксида азота, что в свою очередь усиливает вазоконстрикцию в синусоидах и мелких ветвях воротной вены. Похожий эффект оказывает гиперпродукция эндотелинов от увеличенных эндотелиальных клеток.
Установлено, что асцит в первую очередь формируется внутрипеченочно, внутри печеночных синусоидов. Стенки эндотелиальной выстилки синусоидов имеют относительно большие поры-финестры, необходимые для обеспечения легкого доступа плазмы к гепатоцитам в пространстве Диссе. В перипортальной области имеются выстланные эндотелием, слепо начинающиеся лимфатические капилляры, благодаря чему жидкость из пространства Диссе может попасть в лимфатические капилляры, проходя эндотелиальную стенку. При формировании блока оттока из печени возникает синусоидальная гипертензия. В соответствии с законом Старлинга, повышение синусоидального давления является фактором, усиливающим проникновение элементов плазмы через стенку синусоида в перисинусоидальное пространство Диссе, а затем в лимфатические сосуды, которые компенсируют синусоидальную гипертензию за счет возрастания оттока лимфы из печени.
К системным факторам, способствующим формированию ПГ, можно отнести гипоальбуминемию, активизацию симпатической нервной системы, повышение секреции компонентов ренин-ангиотензиналь-достероновой системы, антидиуретического гормона, предсердного натрийуретического пептида, снижение продукции простагландинов.
В дополнение к вышеперечисленным изменениям, значительное влияние на развитие асцита оказывает гиперальдостеронизм, который включает в себя несколько сложных механизмов:
- активация ренин-ангиотензин-альдостероновой системы, что приводит к повышению уровня альдостерона;
- развитие вторичного гиперальдостеронизма;
- увеличение чувствительности почечных канальцев к альдостерону.
Известно, что концентрация альбумина в сыворотке крови является ведущим фактором, определяющим онкотическое давление. По мере прогрессирования патологического процесса, проявляющегося на морфологическом уровне дистрофически-некротическими процессами в паренхиме и синусоидах, нарушается синтез альбуминов и, как следствие, изменяется проницаемость синусоидального эндотелия. При этом значение гипоальбуминемии и сопутствующих ей изменений онкотических градиентов возрастает.
У большинства больных хроническими гепатитами на цирротической стадии выявлены признаки активации симпатической нервной системы. Повышение уровня катехоламинов в сыворотке крови обнаружено у 60 % пациентов Считается, что снижение эффективного внутрисосудистого объема и гипоальбуминемия способствуют повышению секреции катехоламинов в целях поддержания важнейших го меостатических показателей.
Секреция ренина в почках является одной из важнейших компенсаторных реакций в условиях гиповолемии. Выброс ренина происходит вследствие как гиповолемии, так и гипонатриемии. Ренин вызывает увеличение синтеза ангиотензина, являющегося мощным вазоконстриктором, и стимулирует секрецию альдостерона. Увеличение уровня альдостерона приводит к повышению реабсорбции натрия и воды в почках
Снижение внутрисосудистого объема — сигнал к синтезу антидиуретического гормона опосредованно через волюморецепторы, предположительно расположенные в предсердиях. Физиологическим эффектом антидиуретического гормона является повышение объема циркулирующей плазмы.
Многие исследователи отмечают увеличение уровня предсердного натрийуретического пептида у пациентов с циррозом печени и асцитом. Вероятно, увеличение концентрации этого пептида и задержка натрия при циррозе связаны со снижением чувствительности почек к его действию.
Одним из возможных участников патогенеза асцита рассматривается простагландин Ег, синтезирующийся, в частности, в почках и обладающий вазодилататорным действием. Считается, что степень задержки натрия может быть вызвана снижением продукции этого вазодилататора. При этом простагландины оказываются патогенетически связующим звеном между изменениями гемодинамики на локальном уровне и системными гуморальными реакциями.
Таким образом, в возникновении асцита при заболеваниях печени решающую роль играют гемодинамические и метаболические факторы, которые имеют место на фоне морфологических изменений в печени. Асцит обусловлен выраженной задержкой натрия, а суточная экскреция натрия с мочой при этом состоянии составляет не более 5 ммоль.
Согласно теории «недостаточного наполнения сосудистого русла», задержка натрия и воды почками вторична и обусловлена расширением сосудистого русла внутренних органов. Причиной указанных явлений считается активизация ренин-ангиотензин-альдостероновой системы, симпатической нервной системы, простагландина Ег, способствующая изменению функции почек. При этом натрийуретическому фактору отводится второстепенная роль.
Теория «избыточного наполнения сосудистого русла» предусматривает первичную задержку натрия с дальнейшим увеличением объема циркулирующей плазмы и переходом жидкости в межклеточное пространство.
Ключевое значение имеет активный транспорт жидкости через капиллярные мембраны брюшины. Кроме того, способствующими факторами асцита становится увеличение давления в синусоидах, что наблюдается при циррозе, и сверхобразование лимфы при обструкции синусоидов и печеночных вен.
Диагностика Отечно-асцитического синдрома:
Большое скопление жидкости в брюшной полости можно обнаружить обычными клиническими методами. При перкуссии выявляется притупление звука в боковых отделах живота. Перемещение больных на левый или правый бок вызывает смещение тупости к соответствующему фланку.
При наличии осумкованной жидкости в брюшной полости, при слипчивом перитоните туберкулезной этиологии, кисте яичника перемена положения пациента тимпанит не изменяет. Асцитическую жидкость объемом менее 1,5 л определить клиническими методами не удаегся. В подобных случаях асцит можно определить с помощью УЗИ.
Минимальное количество асцитической жидкости, определяемое указанным методом, составляет 200 мл. УЗИ в ряде случаев позволяет выявить заболевание, явившееся причиной развития асцита (цирроз печени, новообразование органов брюшной полости, панкреатит и др.). После клинического обнаружения асцига в неясных случаях показано проведение диагностического парацентеза с биохимическим и цитологическим исследованиями полученной жидкости. При парацентезе с помощью тонкой иглы получают 50-250 мл асцитической жидкости.
Показаниями для проведения диагностического парацентеза являются;
- новообнаруженный асцит,
- подозрение на наличие злокачественной опухоли,
- необходимость исключения спонтанного бактериального перитонита.
В асцитической жидкости исследуют содержание общего белка, альбумина, глюкозы, холестерина, триглицеридов, билирубина, активности амилазы, а также подсчитывают количество лейкоцитов, эритроцитов и атипичных клеток, проводят окраску бактерий по Граму, выполняют посев жидкости на микрофлору с определением чувствительности к антибиотикам. В. А. Runyon рекомендует рассчитывать сыворотно-асцитический альбуминовый градиент в асцитической жидкости.
СААГ = (альбумин сыворотки) — (альбумин асцитической жидкости), СААГ 1,1 может свидетельствовать о том, что причиной асцита является портальная гипертензия, обусловленная циррозом печени.
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Критерии для диагностики
Жалобы и анамнез Жалобы на увеличение живота в размере (с или без выбухания пупка), ощущение тяжести, переполнения в животе, быстрое удовлетворение чувства голода во время еды, одышку, снижение или отсутствие аппетита, тошноту, рвоту, изжогу, боль, снижение толерантности к физической нагрузке. Анамнез: наличие хронического прогрессирующего заболевания
Физикальное обследование: отечность или выбухание боковых отделов живота, симптом «шум плеска» при аускультации, укорочение перкуторного тона в боковых отделах живота при перемене положения больного или появление тупости в центре живота при коленно-локтевом положении больного, симптом «волны» (данные симптомы определяются при наличии более 1500 мл жидкости в брюшной полости). При выраженной портальной гипертензии на коже живота видна расширенная венозная сеть.
Лабораторные исследования, необходимые для определения синдрома, проведенные до госпитализации в организацию по оказанию паллиативной помощи: не проводятся
Инструментальные исследования, необходимые для определения синдрома, проведенные до госпитализации в организацию по оказанию паллиативной помощи: — УЗИ брюшной полости для определения количества асцитической жидкости (не являются обязательными для госпитализации в организации паллиативной помощи) — УЗИ — разметки для выбора места прокола (не являются обязательными для госпитализации в организации паллиативной помощи)
Примечание: просим вас уточнить, насколько обязательно проведение указанных исследований, так как в противном случае это может ограничить доступ к паллиативной помощи для тяжелобольных пациентов, которые не могут пройти УЗИ-обследование до госпитализации.
Лечение
Цели оказания паллиативной помощи: — улучшение качества жизни пациента — снижение одышки, уменьшение напряженности живота, снижение уровня боли.
Стратегия предоставления паллиативной помощи
Немедикаментозное лечение (режим, диета и пр.): — ограничение поступления жидкости и натрия до 2 г/сут.
Медикаментозное лечение (указываются фармакологические группы, только лекарственные средства, зарегистрированные в РК, МНН, курсовые или суточные дозы, с указанием формы выпуска. При наличии особенностей назначения необходимо указать: внутривенное введение, инсулиновая помпа и т.д.):
Список основных лекарственных средств
Изделия медицинского назначения
Что такое полиативнаямпомощь в больнице при циррозе печени и асците
Мы в соцсетяхВедение больного со стойким асцитом
re>string(5) «27401»03 августа 1996. Для цитирования: Подымова С.Д. Ведение пациента со стойким асцитом. РМЖ. 1996;3:10. Специального внимания требуют следующие клинические ситуации при лечении стойкого асцита:
- обострение печеночно-клеточной недостаточности;
- развитие гепаторенального синдрома;
- основные методы терапии стойкого асцита;
- парацентез с введением альбуминов;
- перитонео-венозное шунтирование;
- трансяремное внутрипеченочное портосистемное шунтирование;
- трансплантация печени.
ПАЛЛИАТИВНАЯ ПОМОЩЬ ПАЦИЕНТАМ С ТОКСИЧЕСКИМИ ГЕПАТИТАМИ И ЦИРРОЗАМИ ПЕЧЕНИ В УСЛОВИЯХ ТЕРАПЕВТИЧЕСКОГО СТАЦИОНАРА
Бугаева Е.И., Лисогурская Н.Г. ПАЛЛИАТИВНАЯ ПОМОЩЬ ПАЦИЕНТАМ С ТОКСИЧЕСКИМИ ГЕПАТИТАМИ И ЦИРРОЗАМИ ПЕЧЕНИ В УСЛОВИЯХ ТЕРАПЕВТИЧЕСКОГО СТАЦИОНАРА // Universum: медицина и фармакология : электрон. научн. журн. 2023. 6(99). URL: https://7universum.com/ru/med/archive/item/15561 (дата обращения: 17.06.2024).
Прочитать статью:DOI — 10.32743/UniMed.2023.99.6.15561
АННОТАЦИЯ
Пациенты, страдающие циррозом печени и токсическими гепатитами, относятся к той категории, которая имеет высокий риск по развитию жизнеугрожающих осложнений (кровотечения из варикозно расширенных вен пищевода, печеночная энцефалопатия, асцит). Их наличие свидетельствует о декомпенсации патологического процесса, что сопровождается резким ухудшением физического и психо-эмоционального состояния пациента, снижением качества жизни. Оказание паллиативной помощи в условиях стационарного лечения направлено на повышение эффективности лечебных мероприятий, улучшение показателей объективных данных, повышение качества жизни.
Паллиативная помощь оказывается мультидисциплинарной бригадой в составе которой медицинские работники (врачи разных специальностей, медицинские сестры), психологи, социальные работники.
Только сплоченная работа такой бригады специалистов как с пациентом, так и с его родственниками позволит справиться с задачами лечения, социального функционирования и улучшения качества жизни у пациентов с заболеваниями печени.
ABSTRACT
Пациенты, страдающие циррозом печени и токсическим гепатитом, находятся в группе с высоким риском развития критических осложнений (кровотечения из пищеводных вен, печеночная энцефалопатия, асцит). Эти состояния свидетельствуют о декомпенсации патологического процесса, что характеризуется резким ухудшением физического и психоэмоционального состояния пациентов, а также снижением качества жизни. Паллиативная помощь в стационарных условиях нацелена на повышение эффективности лечебных мер, улучшение объективных данных и повышение качества жизни.
Palliative care is provided by a multidisciplinary team, which includes medical workers (doctors of various specialties, nurses), psychologists, social workers.
Только слаженная работа команды специалистов с пациентом и его родственниками позволит решить задачи, связанные с лечением, социальной адаптацией и повышением качества жизни пациентов с заболеваниями печени.
Keywords: cirrhosis, decompensation, palliative care, hepatitis, quality of life.
Введение. В 2014 г. Всемирной ассамблеей здравоохранения была признала важность оказания паллиативной помощи, в связи с чем она была включена в структуру здравоохранения в лечении пациентов с любым состоянием, ограничивающим продолжительность его жизни [1]. Всемирная организация здравоохранения (2020 г.)определила паллиативную помощь как «подход, улучшающий качество жизни пациентов и их семей, столкнувшихся с проблемами, связанными с опасными для жизни заболеваниями, путем раннего выявления, правильной оценки и лечения проблем физического, психосоциального и духовного состояний».
Согласно мнению большинства исследователей, паллиативная помощь — это комплекс мероприятий, направленных на улучшение качества жизни людей с неизлечимыми болезнями, который включает медицинскую, социальную и психологическую поддержку как больного, так и его семьи [2; 3].
Было предложено оказывать паллиативную помощь пациентам и их семьям непрерывно с момента постановки диагноза до конца жизни. Было подтверждено, что паллиативная помощь улучшает качество жизни пациентов, облегчает симптомы и оказывает положительное влияние на лиц, осуществляющих уход.
В настоящее время растет спрос на паллиативную помощь неонкологическим пациентам [4]. Среди них первостепенное значение имеют больные с терминальной стадией заболеваний печени. Терминальная стадия заболеваний печени при циррозах и токсических гепатитах является кульминацией прогрессирования патологического процесса, относится к необратимому повреждению печени и ее функции .
Развитие таких значимых клинических осложнений, какасцит, печеночная энцефалопатия желудочно-кишечное кровотечение, желтуха, знаменует собой переход от компенсированной к декомпенсированной стадии цирроза печени, требует тщательного наблюдения и ухода с привлечением специалистов разного профиля: врачей, медицинских сестер, психологов, социальных работников.
Наличие неопасных для жизни осложнений, как мышечная атрофия, кахексия, мышечные судороги, зуд, утомляемость, бессонница, боль, депрессия и тревога оказывают негативное влияние на качество жизни пациента, ограничивают его социальное функционирование.
Таким образом, важность паллиативной помощи для данной группы пациентов на всех стадиях их лечения не вызывает сомнения, а ее развитие является одной из главных задач в области здравоохранения.
Цель работы — анализ литературных данных по вопросу оказания паллиативной помощи пациентам с токсическими гепатитами и циррозами в условиях терапевтического стационара.
Потенциальные преимущества паллиативной помощи на терминальной стадии заболевания печени включают повышение качества жизни пациентов, снижение частоты повторных госпитализаций и уменьшение необходимости в инвазивных процедурах (торакоцентез, лапароцентез) [5].
Медицинские показания к оказанию паллиативной медицинской помощи подразделены на общие и по группам заболеваний и состояний. Перечень общих показаний приведен в Таблице 1.
Таблица 1.
Характеристика общих показаний к паллиативной помощи

Медицинские показания к оказанию паллиативной медицинской помощи взрослым при болезнях печени (цирроз/токсический гепатит) в условиях терапевтического стационара следующие:

Посредством паллиативного лечения можно контролировать симптоматику, а также побочные эффекты лечения.
Симптоматическое лечение (облегчение тяжелых проявлений заболевания) включает:
- уменьшение боли;
- помощь в снижении одышки (уменьшение затруднения дыхания).

На этапе стационарного наблюдения за пациентами особенно важно строго соблюдать режим питания и отдых. Рекомендуется использовать преимущественно молочно-растительную витаминизированную диету, с акцентом на растительные жиры; острые, жареные и маринованные блюда должны быть исключены. Пациентам необходимо соблюдать постельный режим, который предполагает должный уход и комфорт для больного в постели. Физические нагрузки должны быть ограничены, количество соли в пищу следует сократить до 5 г в сутки, а потребление жидкости — до 1 литра. При проявлении симптомов печеночной энцефалопатии необходимо уменьшить количество употребляемого белка. Питание должно быть дробным и организованным не реже 4-5 раз в день; важно контролировать объем выделяемой мочи, вес пациента, а также следить за приемом назначенных медикаментов. В случае появления сухости, зуда и высыпаний на коже необходимо обеспечить тщательный уход за кожей [7].
Лечебно-сестринский уход направлен на предупреждение специфических осложнений, просветительскую работу и поддержку, рекомендации относительно профилактических мер и признаков прогрессирующей декомпенсации, изменение образа жизни и уход, который должны выполнять за собой пациенты для достижения лучшего клинического результата.
Медикаментозной терапии принадлежит ведущая роль в лечебном процессе. Следует максимально ограничить количество лекарственных препаратов и использовать строго по показаниям только необходимые и эффективные средства.
При наличии напряженного асцита (третья степень) рекомендуется проводить тотальный парацентез с последующим внутривенным введением 20% раствора альбумина, исходя из расчета 8 граммов противовеса на каждый литр удаленной асцитической жидкости, чтобы предотвратить возможные гемодинамические нарушения. Симптоматическое лечение может включать повторные парацентезы с частотой 1 раз в 2–4 недели, совместно с трансфузиями альбумина. У пациентов с установленным диагнозом резистентного асцита диуретики отменяются и не назначаются в будущем, такие больные попадают в лист ожидания для трансплантации печени. До операции по пересадке печени возможно осуществление трансъюгулярного портосистемного шунтирования или применение автоматизированного насоса по низкопоточному принципу (Alfapump, Saphymo GmbH, Германия) [8].
В тех клинических ситуациях, когда цирроз печени является исходом хронического вирусного гепатита, возможно использование противовирусных препаратов парентерально (альфа – интерферон) или внутрь (рибавирин). При развитии цирроза печени на фоне хронического аутоиммунного гепатита применяют кортикостероиды (преднизолон и др.) и цитостатические препараты (азатиоприн и др.). Достаточно широко применяют гепатопротекторы (эссенциале – форте, карсил, глютаминовая кислота и др.). Универсальными лечебными средствами, улучшающими пищеварение являются полиферментные препараты (мезим – форте, креон и др.).
Частота диагностики варикозного расширения вен у пациентов с циррозами печени/токсическими гепатитами составляет 50%, при этом у трети пациентов впоследствии развиваются кровотечения из варикозно расширенных вен, летальный исход при этом может достигать 30%. Ранее предпочтение в поддерживающей терапии отдавалось неселективным бета-блокаторам (например, пропранололу) после проведения эндоскопического лигирования. Пропранолол блокирует адренергический дилататорный тонус в мезентериальных артериолах, что приводит к беспрепятственной альфа-адренергической вазоконстрикции и, следовательно, к уменьшению портального притока. Однако в настоящее время все большее число исследователей отдают предпочтение карведилолу, который демонстрирует снижение измерений градиента печеночного венозного давления у людей с циррозом печени/токсическими гепатитами. В рандомизированном контролируемом исследовании, в котором сравнивали карведилол и лигирование, Tripathietal.показали, что пациенты, получавшие карведилол, имели более низкую частоту первичного кровотечения из варикозно расширенных вен без различий в смертности [9].
Применение антибактериальной терапии у пациентов с кровотечениями из варикозных расширенных вен способствует общему снижению инфекционных осложнений, показателя смертности и риска повторных кровотечений. Следует отметить, что выбор антибиотика и продолжительность его приема до сих пор дискутируются.
В лечении хронических болевых синдромов могут быть использованы несколько методик (пероральный прием болеутоляющих, блокада периферических нервов, в том числе и продленных блокад с использованием микрокатетеров и микроинфузионных помп, пролонгированная эпидуральная анальгезия с применением современных помп и дозаторов). Все виды регионарной анестезии необходимо выполнять под контролем УЗИ-навигации, что улучшает профиль безопасности и комфорт пациента, снижает риск осложнений.
В особенно сложных случаях могут быть проведены эндоскопические паллиативные вмешательства, такие как восстановление просвета с помощью саморасправляющихся стентов и стентирование желчных протоков. Операции могут включать устранение кишечной непроходимости, наложение стом и анастомозов.
Общая поддерживающая терапия пациентов с печеночной энцефалопатией включает предотвращение обезвоживания и нарушений электролитного баланса, обеспечение нутритивной поддержки.
Зуд у пациентов с холестазом может быть как генерализованным, так и локализованным (часто ощущается на ладонях и подошвах). Основные меры, которые должны быть обеспечены медицинским персоналом: применение смягчающих средств для местного использования, поддержание прохладного и увлажненного воздуха, минимизация использования агрессивных мыл и моющих средств.
Фармакологическая терапия может быть рассмотрена для пациентов с зудом от умеренной до тяжелой степени (секвестранты желчных кислот).
Наличие цирроза/токсического гепатита оказывает неблагоприятное воздействие на личность пациента, его когнитивные функции, уровень социального взаимодействия. В связи с этим важное значение должно отводиться роли психолога и социального работника. В работе с пациентами могут быть использованы медикаментозные и немедикаментозные методы (групповая/индивидуальная психотерапия, когнитивно-поведенческая терапия). У пациентов с токсическими гепатитами необходима работа социального работника для восстановления утраченных связей с родственниками и/или другим окружением для лучшей адаптации в обществе после проведенного стационарного этапа лечения [ 9 , 10 ].
Таким образом, паллиативная медицинская помощь помогает пациенту с циррозом печени справиться с пониманием того тяжелого факта, что в дальнейшем придется жить с неизлечимым заболеванием, планировать будущее, учитывая свое состояние здоровья [12].
Социальная изоляция в популяционных исследованиях ассоциируется с повышенной смертностью и увеличением числа несчастных случаев и самоубийств среди пациентов с токсическими гепатитами и циррозами печени. Социальные работники, входящие в состав междисциплинарных групп, играют важнейшую роль в решении психосоциальных вопросов при лечении хронических заболеваний, предлагая индивидуализированную помощь как пациентам, так и их семьям (дополнительный уход, организация досуга, улучшение условий пребывания, помощь в трудоустройстве, культурные мероприятия, юридическая поддержка) [11]. При оказании паллиативной помощи в стационаре предусмотрено, что родственники могут круглосуточно находиться рядом с пациентом, если это соответствует его желаниям и не нарушает права других пациентов, с учетом соблюдения санитарно-эпидемиологических норм.
Вывод. Функциональное влияние прогрессирующего заболевания печени на повседневную активность и качество жизни приводит к тому, что у пациентов возникает множество физических, психологических и психосоциальных проблем, решение которых может быть достигнуто на этапе стационарного лечения.
Что такое полиативнаямпомощь в больнице при циррозе печени и асците
Егай А.А. 1 Бебезов Б.Х. 1 Казакбаев А.Т. 1 Двумаров А.А. 1 Тентимишев А.Э.
2 Фейгин А.М. 2 Суров Э.А. 1
1 Кыргызско-Российский Славянский университет им. Б.Н. Ельцина2 Национальный госпиталь при министерстве здравоохранения Кыргызской Республики
Печеночный гидроторакс – это плевральный выпот у пациентов с циррозом печени и портальной гипертензией в отсутствие заболеваний сердца и легких. До сих пор образование печеночного гидроторакса до конца не изучено, наиболее приемлемое объяснение – это прямое попадание асцитической жидкости в плевральную полость через дефекты в диафрагме на фоне повышения давления в брюшной полости и под действием присасывающей силы негативного давления в плевральной полости.
Клиническое течение печеночного гидроторакса может варьироваться от полного отсутствия симптомов до наличия одышки, сухого кашля и болевого синдрома. В некоторых случаях медикаментозное лечение, соблюдение питьевого режима и ограничение соли не оказывают должного эффекта на плевральный выброс, и в таких ситуациях следует говорить о рефрактерном течении.
Таким образом, возникает необходимость постоянных процедур торакоцентеза и, как следствие, повышается риск осложнений, связанных с ними. В данной статье приведены результаты применения химического плевродеза йодповидоном в качестве паллиативной помощи данной категории пациентов. Приведены особенности индукции плевродеза при наличии асцита. К тому же оценена не только эффективность, но и безопасность применения йодповидона.
488 KBцирроз печенипеченочный гидротораксасцитплевродезйодповидон
1. Arroyo V., Ginès P., Gerbes A.L., Dudley F.J., Gentilini P., Laffi, G., Reynolds T.B., Ring-Larsen H., Schölmerich J. Definition and diagnostic criteria of refractory ascites and hepatorenal syndrome in cirrhosis. International Ascites Club. Hepatology (Baltimore, Md.). 1996. Vol.
23. № 1. Р. 164–176. DOI: 10.1002/hep.510230122.
2. Machicao V.I., Balakrishnan M., Fallon M.B. Pulmonary complications in chronic liver disease. Hepatology. 2014. Vol.
59. № 4. P. 1627–1637. DOI: 10.1002/hep.26745.
3. Singh A., Bajwa A., Shujaat A. Evidence-based review of the management of hepatic hydrothorax. Respiration. 2013. Vol. 86. № 2. P. 155–173.
DOI: 10.1159/000346996.
4. Runyon B.A., AASLD Practice Guidelines Committee. Management of adult patients with ascites due to cirrhosis: an update. Hepatology (Baltimore, Md.). 2009. Vol.
49. № 6. Р. 2087–2107.
DOI: 10.1002/hep.22853.
5. Chen A., Massoni J., Jung D., Crippin, J. Indwelling Tunneled Pleural Catheters for the Management of Hepatic Hydrothorax. A Pilot Study. Annals of the American Thoracic Society. 2016. Vol.
13. № 6. P. 862–866. DOI: 10.1513/AnnalsATS.201510-688BC.
6. Bernardi M., Moreau R., Angeli P., Schnabl B., Arroyo V. Mechanisms of decompensation and organ failure in cirrhosis: from peripheral arterial vasodilation to systemic inflammation hypothesis. Journal of hepatology. 2015. Vol. 63. № 5. P. 1272–1284.
DOI: 10.1016/j.jhep.2015.07.004.
7. Norvell J.P., Spivey J.R. Hepatic hydrothorax. Clinics in liver disease. 2014. Vol.
18. № 2. P. 439–449.
DOI: 10.1016/j.cld.2014.01.005.
8. Huang P.M., Kuo S.W., Chen J.S., Lee J.M. Thoracoscopic mesh repair of diaphragmatic defects in hepatic hydrothorax: a 10-year experience. The annals of thoracic surgery. 2016. Vol.
101. № 5. P. 1921–1927. DOI: 10.1016/j.athoracsur.2015.11.023.
9. Kim J.S., Kim C.W., Nam H.S., Cho J.H., Ryu J.S., Lee H.L. Hepatic hydrothorax without ascites as the first sign of liver cirrhosis. Respirology case reports. 2015. Vol.
4. № 1. Р. 16–18.
DOI: 10.1002/rcr2.140.
10. Ivashkin V.T., Mayevskaya M.V., Pavlov C.S., Fedosyina Y.A., Bessonova Y.N., Pirogova I.Y., Garbuzenko D.V. Treatment of liver cirrhosis complications: Clinical guidelines of the Russian Scientific Liver Society and Russian gastroenterological association. Ros Zhurn Gastrojenterol, Gepatol, Koloproktol. 2016. Vol.
26. № 4. P. 71–102.
DOI: 10.22416/1382-4376-2016-26-4-71-102.
11. Solà E., Solé C., Ginès P. Management of uninfected and infected ascites in cirrhosis. Liver international: official journal of the International Association for the Study of the Liver. 2016. Vol. 36.
No. 1. P. 109–115. DOI: 10.1111/liv.13015.
12. Lv Y., Han G., Fan D. Hepatic Hydrothorax. Annals of hepatology. 2018. Vol. 17. № 1. Р. 33–46.
DOI: 10.5604/01.3001.0010.7533.
13. Orman E.S., Lok. A.S. Outcomes of patients with chest tube insertion for hepatic hydrothorax.Hepatology international. 2009. Vol.
3. No.
4. P. 582–586. DOI: 10.1007/s12072-009-9136-z.
14. Suarez P.M., Gilart J.L. Pleurodesis in the treatment of pneumothorax and pleural effusion. Monaldi Arch Chest Dis. 2013. Vol.
79. No. 2. P. 81–86.
15. Jung Y. Surgical Treatment of Hepatic Hydrothorax: A «Four-Step Approach». The Annals of thoracic surgery. 2016. Vol. 101.
No.
3. P. 1195–1197. DOI: 10.1016/j.athoracsur.2015.04.110
Патологическое накопление жидкости в плевральной полости, называемое гидротораксом, может быть одним из осложнений декомпенсированного цирроза печени (ЦП). Одним из наиболее первых, клинически значимых, осложнений ЦП является асцит, примерно в 10–20 % асцит не поддается медикаментозной коррекции [1].
Гидроторакс печени (ГТП) представляет собой накопление жидкости в плевральной полости объемом более 500 мл у больных с циррозом печени, при этом исключая сопутствующие заболевания сердца и легких [2]. Он встречается реже, чем асцит — приблизительно у 15% пациентов с циррозом, из которых 25% случаев гидроторакса не поддаются консервативному лечению [3].
Даже небольшой объем гидроторакса может вызвать клинические проявления дыхательной недостаточности. Когда течение асцита и ПГ не поддается стандартному лечению, появляется необходимость в хирургических манипуляциях, направленных на эвакуацию жидкости (парацентез, торакоцентез). Данные процедуры ложатся тяжким бременем как на пациентов, так и на систему здравоохранения. Согласно практическим рекомендациям 2009 г. Американской ассоциации по изучению заболеваний печени, постановка дренажа в брюшную и плевральную полости противопоказана, так как это достоверно приводит к увеличению смертности [4]. Однако данные рекомендации сделаны без полного описания типа дренажной системы и не указывают цели манипуляции.
В 2016 г. произведено исследование, в котором были получены положительные результаты катетеризации плевральной полости у пациентов с ЦП, которые были кандидатами на трансплантацию печени [5]. В статье приводилось наблюдение 24 пациентов, из них у 4 (16,7 %) возникло инфицирование плевральной полости, трем из которых это не помешало успешно произвести трансплантацию печени [5]. У 8 пациентов (33,3 %) имел место спонтанный плевродез, что позволило удалить дренаж из грудной полости [5].
Основным патогенетическим звеном в развитии асцита является портальная гипертензия. Печень является единственным органом, синтезирующим альбумин, таким образом, поражение печени приводит к гипоальбуминемии, что ведет к снижению онкотического давления, что Ведет к образованию асцита.
В последнее время общепринятой является гипотеза периферической артериальной вазодилятации [6]. Портальная гипертензия увеличивает поступление вазодилятаторов в кровяное русло, что постепенно ведет к застою крови в сосудах органов брюшной полости. Данное состояние вызвано активацией симпатической нервной системой, ренин-ангиотензин-альдостероновой системы, секрецией вазопрессина, что ведет к задержке натрия и выходу жидкости во внесосудистое пространство, в частности в брюшную полость [6]. Другим источником вазодилятаторов может быть кишечник, когда продукты жизнедеятельности бактерий стимулируют высвобождение провоспалительных цитокинов, что ведет к расширению сосудов органов брюшной полости [6].
Причины возникновения ГТП при циррозе печени объясняются несколькими теоретическими подходами, включая нарушение функций печени, что приводит к снижению онкотического давления из-за гипоальбуминемии, повышение давления в системе непарных вен, а также миграцию асцитической жидкости через диафрагму в плевральное пространство [7]. Однако наиболее распространенной считается теория проникновения жидкости из брюшной полости через диафрагмальные дефекты. Описание и классификация этих дефектов проведены P.M. Huang и др., которые также предложили метод торакоскопического закрытия диафрагмальных дефектов сеткой [8]. Эта теория также подходит для объяснения изолированного гидроторакса, поскольку при таком состоянии скорость резорбции асцитической жидкости плеврой соответствует скорости образования асцита в брюшной полости [9].
Пункция плевральной полости применяется у пациентов с ПГ, резистентных к консервативному лечению, при наличии клинических признаков плеврального выпота, таких как одышка и сухой кашель. При декомпенсированном состоянии ЦП эффект от торакоцентеза кратковременный, что ведет к необходимости повторных пункций.
Процедура эвакуации жидкости из плевральной полости вызывает потерю белка и электролитов. Следует отметить, что торакоцентез может вызвать осложнения, такие как пневмоторакс, кровотечения, инфекционные процессы в плевральной полости, повреждения печени и селезенки, а также болевой шок и отек легких, при этом вероятность возникновения осложнений растет с каждым повторным вмешательством [12].
К дренированию плевральной полости необходимо подходить с крайней осторожностью, так как существует риск таких осложнений, как обильная потеря белка, вторичная инфекция, пневмоторакс, гемоторакс, печеночно-почечный синдром, нарушение электролитного баланса [13]. Традиционно считалось, что показаниями к дренированию плевральной полости являются эмпиема плевры и пневмоторакс.
Сейчас данная процедура стала общепринятой в лечении пациентов с рецидивными и рефрактерными плевральными выпотами, при этом затяжное нахождение трубки в грудной полости удается прервать индукцией плевродеза. Химический или медикаментозный плевродез – это искусственная инициация асептического воспаления париетального и висцерального листка плевры путем введения местнораздражающего вещества. В результате чего происходит нивелирование плевральной полости и, как следствие, такие состояния, как плевральный выпот и пневмоторакс, не имеют место быть. Плевросклерозант вводится в плевральную полость либо через дренаж, либо во время лечебно-диагностической плевроскопии или торакоскопии. Наиболее распространенными химическими веществами являются тальк, тетрациклин и его производные, йодповидон, нитрат серебра, цитостатические препараты [14].
Цель исследования заключалась в оценке эффективности использования йодоповидона для лечения рефрактерного плеврального выпота при циррозе печени, а также асците. Мы пытались установить безопасность данного метода плевродеза, основываясь на показателях гемодинамики, температурной реакции и уровне болевой активности. Обращалось внимание на особенности проведения плевродеза в условиях одновременно присутствующего асцита и плеврального выпота.
Материалы и методы исследования
Исследование проводилось на базе клиники имени И.К. Ахунбаева Национального госпиталя при Министерстве здравоохранения Кыргызской Республики. Стоит отметить, что в данном медицинском учреждении располагается ведущее отделение торакальной хирургии республики.
В период с сентября 2019 г. по октябрь 2021 г. на стационарном лечении в отделении находилось 12 пациентов с циррозом печени различной этиологии в возрасте от 41 до 67 лет, из них 6 мужчин (50 %) и 6 женщин (50 %). Все пациенты находились на постоянном наблюдении у гастроэнтеролога, периодически проходя коррекцию лечения стационарно. Несмотря на это, у больных развились такие осложнения, как портальная гипертензия, асцит и гидроторакс. Правосторонний гидроторакс имел место во всех 12 случаях, из них в 3 случаях (25 %) было отмечено наличие небольшого выпота в левой плевральной полости.
В стадии декомпенсации ЦП, невзирая на коррекцию медикаментозного лечения, у пациентов развивалась клиника дыхательной недостаточности, с целью ее купирования проводились процедуры торакоцентеза, больные, у кого течение ПГ носило рецидивный и рефрактерный характер, были госпитализированы в отделение торакальной хирургии для проведения процедуры ХП. Учитывая, что ранее индукция плевродеза не проводилась и данный способ лечения не входит в протоколы Министерства здравоохранения Кыргызской Республики, у всех пациентов было взято информированное согласие.
В исследование не были включены участники с предыдущими аллергическими реакциями на йод, заболеваниями щитовидной железы, ригидной легкостью и с ожидаемой продолжительностью жизни менее 30 дней.
Методика ХП включала в себя дренирование плевральной полости, обезболивание листков плевры, и сама процедура плевродеза проводилась только после полного раборьбы легкого, подтвержденного рентгенографически. Местная анестезия достигалась путем введения через плевральный дренаж 50 мл 1 % раствора лидокаина, экспозиция составляла 20 мин. Далее анестетик из плевральной полости удалялся, и внутриплеврально вводилось 20 мл 10 % раствора йодповидона, дренаж перекрывался на 2 ч, для достижения максимальной площади воздействия больным рекомендовано периодическое изменение положения тела и активные дыхательные движения.
Эффективность терапии оценивалась по снижению объема выделяемой жидкости до 100 мл, что позволяло удалить дренаж из плевральной полости. После выписки пациенты находились под амбулаторным наблюдением у торакального хирурга с контрольными визитами через 1, 3, 6 месяцев, а затем раз в год. Безопасность процедуры проверялась по основным показателям гемодинамики, температурной реакции и болевой активности.
Результаты исследования и их обсуждение
Статистическая обработка данных проводилась с помощью программы IBM Statistics 28.0.
В 11 случаях (91,7%) причиной цирроза печени стал хронический вирусный гепатит, в 1 случае (8,3%) — первичный билиарный цирроз. У 9 пациентов (75%) в момент обращения наблюдался субтотальный накопленный объем жидкости, у 2 (16,7%) — правый гемоторакс был полностью затенён, а у 1 пациента (8,3%) рентгенограмма выявила гидропневмоторакс с тотальным коллапсом правого легкого (изображение), что, вероятнее всего, стало следствием многих пункций плевральной полости. Для предотвращения смещения средостения, эвакуация жидкости из грудной полости проводилась одновременно поэтапно, за первые сутки было удалено от 2800 до 4100 мл жидкости. Суточный объем выделяемой жидкости колебался от 350 до 1400 мл. У всех пациентов был диагностирован асцит, различающийся по степени тяжести: умеренный асцит у 9 (75%) и тяжёлый асцит у 3 (25%) случаев.
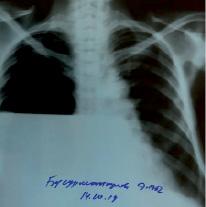
Правосторонний гидропневмоторакс. Рентгенограмма в прямой проекции, где отмечается наличие горизонтального уровня жидкости с верхней границей у переднего отрезка III ребра
В 6 случаях (50 %) ХП был произведен без предварительной эвакуации жидкости из брюшной полости. Таким образом, не был достигнут минимальный объем ежедневной экссудации в 100 мл, который мог бы позволить удалить дренаж из плевральной полости. Все 6 пациентов были выписаны на амбулаторное наблюдение и лечение с дренажными трубками из плевральной полости.
Стоит отметить, что данная когорта пациентов находилась на стационарном лечении в торакальном отделении хронологически раньше. Безуспешность ХП можно объяснить непрерывной миграцией асцитической жидкости в плевру и, как следствие, изменением концентрации действующего вещества. В результате амбулаторного наблюдения у 2 пациентов (33,3 %) поступление жидкости прекратилось в течение 12 и 14 дней без дальнейшего рецидива, у 4 пациентов (66,7 %) в результате длительного нахождения плевральной трубки развилась эмпиема плевры, что в 3 случаях привело к облитерации плевры в течение одного месяца, в 1 случае после разрешения эмпиемы плевры и удаления дренажа имел место рецидив эмпиемы через 3 месяца. Данные об эффективности ХП представлены в табл. 1.
Сравнение эффективности применения йодоповидона у пациентов с циррозом печени без лапароцентеза и с лапароцентезом (p < 0,05)
Количество дней до удаления дренажа после ХП
Лечение цирроза печени
Цирроз печени – заболевание, которое характеризуется замещением здоровых гепатоцитов (клеток печени) клетками соединительной ткани вследствие имеющихся болезней печени.
При замене здоровых клеток на паталогические происходит процесс фиброзирования, который может нарушить функции печени. В настоящее время более 200 миллионов людей страдают от хронических заболеваний печени, среди которых 14 миллионов имеют подтвержденный цирроз. По статистике, 50% случаев цирроза вызывает алкогольная болезнь.
Среди других причин развития болезни
- Вирусный гепатит B, C, D, G;
- Заболевания органов пищеварения, в основном желчнокаменная болезнь;
- Аутоиммунные болезни;
- Наследственные нарушения обмена веществ;
- Синдром Бадда-Киари (проблемы с венозным оттоком);
- Употребление препаратов, имеющих токсический эффект на печень;
- Неалкогольная жировая болезнь печени, которая может прогрессировать от стеатоза до стеатогепатита, фиброза и цирроза;
- Отравления химическими веществами.
Клинические проявления цирроза печени могут быть различными. К сожалению, чаще они неспецифичны, и пациенты обращаются к врачу, когда их начинает беспокоить:
- Пожелтение кожи и склер;
- Нарушения пищеварительных функций;
- Увеличение живота за счёт асцита (скопление жидкости в брюшной полости) и сопутствующие симптомы;
- Боли и чувство распирания в правом подреберье;
- Зуд, сосудистые звездочки на коже;
- Нарушения менструального цикла у женщин и гормональные расстройства у мужчин;
- В тяжелых случаях возможны серьезные осложнения: портальная гипертензия, асцит, печеночная энцефалопатия, варикозное расширение вен пищевода и желудка, печеночная недостаточность и сбои в работе сердца.
При осмотре врача, помимо вышеописанных симптомов, обнаруживается увеличение размеров печени и селезенки, а также их болезненность. Для подтверждения диагноза назначаются лабораторно-инструментальные исследования. Они включают в себя биохимические анализы, общий анализ крови, тесты на наличие инфекций, УЗИ печени и главной печёночной вены (v. portae). Возможно также использование метода пункционной биопсии.
Прием пациентов на стационарное лечение осуществляется круглосуточно, без выходных и праздников. Предварительно Вам необходимо проинформировать нашего администратора о своем намерении лечиться у нас по телефону +7 (495) 728 02 78.
Лечение цирроза комплексное, и основано на устранении или уменьшении влияния основного заболевания. Рекомендуется дезинтоксикационная и антиоксидантная терапия, а также лечение, направленное на улучшение функций ЖКТ, специфическая терапия при наличии осложнений. При неэффективности лечение необходима трансплантация печени.
В медицинском центре «АСС Медикал» пациенты с циррозом печени могут пройти полное обследование и курс лечения гепатопротекторами, антиоксидантами и метаболически активными веществами. Также мы восстанавливаем белково-энергетический баланс с помощью парентерального питания (внутривенного), которое часто нарушается при циррозе печени. Важно отметить, что сбои в белковом обмене еще больше ухудшают функциональность печени.
У пациентов с асцитом при белково-энергетическом дефиците намного быстрее накапливается свободная жидкость в брюшной полости, что связано со снижением онкотического давления в плазме крови, которое поддерживается нормальным уровнем белковых структур в крови.
Медикаментозная терапия, которую мы предоставляем, способствует значительному улучшению различных процессов в организме пациента и повышению его качества жизни.
При наличии напряжённого асцита мы проводим лапароцентез (пункция и дренирование брюшной полости с эвакуацией асцитической жидкости). Параллельно с лапароцентезом стоит провести курс восстановительного лечения.
При портальной гипертензии мы проводим специальную терапию, направленную на снижение давления в портальной системе кровоснабжения, что в разы снижает риск кровотечений из варикозно расширенных вен пищевода и кишечника.








